Esta web utiliza cookies para que podamos ofrecerte la mejor experiencia de usuario posible. La información de las cookies se almacena en tu navegador y realiza funciones tales como reconocerte cuando vuelves a nuestra web o ayudar a nuestro equipo a comprender qué secciones de la web encuentras más interesantes y útiles.

En 2016, los laboratorios del Centro Nacional de Investigaciones Oncológicas (CNIO) han generado una gran cantidad de conocimiento. La producción científica, con un buen porcentaje de trabajos publicados en revistas de alto impacto, sigue siendo de calidad. Así se refleja en rankings como Nature Index o Mapping Scientific Excellence, que sitúan al CNIO entre los 10 mejores centros de investigación del cáncer del mundo. Es imposible mencionar todos los estudios en los que han participado nuestros investigadores así que hemos recopilado los más importantes.
EL HITO DE LA REPROGRAMACIÓN CELULAR ‘IN VIVO’
Fue en 2013 cuando Manuel Serrano y su equipo del Grupo de Supresión Tumoral hicieron público lo que fue considerado por muchos, entre ellos Nature Medicine, uno de los hitos científicos del año. Habían logrado que las células de un ratón se reprogramasen, es decir, volvieran a un estadio similar al embrionario. Hasta entonces, sólo se había logrado ‘in vitro’. A finales de noviembre de este año, este mismo grupo ha logrado un nuevo avance en este campo al demostrar que la reprogramación ‘in vivo’ y la senescencia y el daño tisular son procesos que van de la mano. Sus descubrimientos, recogidos en las páginas de Science, suponen un cambio en la idea que teníamos hasta ahora del proceso de reprogramación celular.
LA BIOCOMPUTACIÓN REVELA LOS SECRETOS DEL EPIGENOMA
El objetivo del proyecto BLUEPRINT era generar al menos 100 epigenomas de referencia de distintos tipos de células hematopoyéticas de individuos sanos y sus equivalentes malignos. A su finalización, todos los resultados del proyecto se hicieron públicos de forma simultánea junto con los del Consorcio Internacional para el estudio del Epigenoma Humano (IHEC, por sus siglas en inglés), en el que se enmarca BLUEPRINT.
Antes, ya se habían hecho públicos algunos estudios realizados por el Grupo de Biología Computacional Estructural, dirigido por Alfonso Valencia, en el marco del IHEC y el BLUEPRINT. En el mes de enero, la revista Cell Reports recogía en sus páginas el hallazgo de la primera red de comunicación del epigenoma, descifrada gracias a la teoría de redes de internet. En agosto, el uso de la teoría de redes –en concreto de una de sus propiedades: la asortatividad- ayudaba a descifrar los mecanismos de organización 3D del ADN.
20 AÑOS DE TELÓMEROS
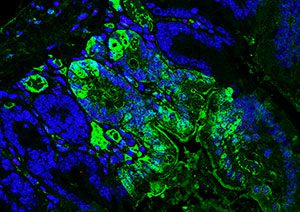 En 2016 hemos celebrado un aniversario muy especial, los 20 años que lleva Maria A. Blasco estudiando los telómeros. En diciembre se celebró en el CNIO una jornada a la que asistieron varios investigadores que han pasado durante estos años por los laboratorios del Centro y que han colaborado con la actual Directora del CNIO y jefa del Grupo de Telómeros y Telomerasa en este campo. A lo largo del año, además, el grupo dirigido por Blasco ha constatado la presencia en las células humanas de unos ARN denominados TERRA que protegen a los telómeros.
En 2016 hemos celebrado un aniversario muy especial, los 20 años que lleva Maria A. Blasco estudiando los telómeros. En diciembre se celebró en el CNIO una jornada a la que asistieron varios investigadores que han pasado durante estos años por los laboratorios del Centro y que han colaborado con la actual Directora del CNIO y jefa del Grupo de Telómeros y Telomerasa en este campo. A lo largo del año, además, el grupo dirigido por Blasco ha constatado la presencia en las células humanas de unos ARN denominados TERRA que protegen a los telómeros.
Estas estructuras situadas en los extremos de los cromosomas están relacionadas con el envejecimiento, tal y como demuestra el hecho de que alargar su longitud aumenta la esperanza de vida de los ratones hasta en un 40%. En un trabajo publicado este año, el equipo de Blasco muestra que es posible aumentar la longitud de los telómeros sin emplear la terapia génica y, por tanto, evitando los riesgos asociados a ella.
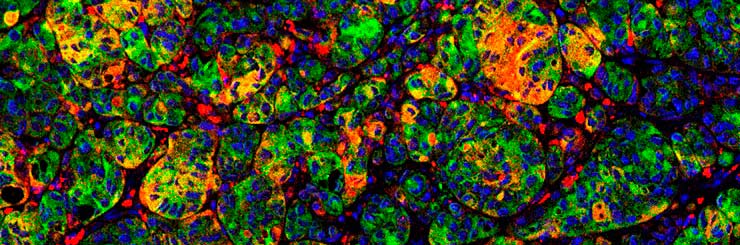
- Cáncer de pulmón. El Grupo de Oncología Experimental dirigido por Mariano Barbacid mostraba en las páginas de Nature Medicine que la combinación específica de los fármacos dasatinib y demcizumab reduce los tumores de pulmón mediados por KRAS, los más agresivos y con menor supervivencia.
- Anemia aplásica. Dado que muchas formas de esta enfermedad presentan acortamiento de los telómeros, el Grupo de Telómeros y Telomerasa probó la terapia génica para alargar estas estructuras e intentar frenar así la anemia aplásica en varios modelos de ratón.
- Cáncer de mama y pulmón. Muchos pacientes desarrollan resistencia a los fármacos antiangiogénicos (muy comunes). La Unidad de Investigación Clínica en Cáncer de Mama, dirigida por Miguel Quintela, ha demostrado cómo el uso de un antidiabético puede revertir esta resistencia.
- Leucemia mieloide y Sarcoma de Ewing. Ambos tumores, frecuentes sobre todo en niños y adolescentes, tienen una mala respuesta a los tratamientos existentes. Los inhibidores ATR podrían en un futuro ser útiles para combatirlos, a la luz de las investigaciones del Grupo de Inestabilidad Genómica.

- Una diana para atacar a MYC. MYC es un gen que está alterado en más de la mitad de los cánceres humanos, y a menudo se lo asocia a tumores muy agresivos. El Grupo de Carcinogénesis Epitelial dirigido por Francisco X. Real identificó un gen llamado BPTF, que tiene un importante papel en la cadena de sucesos moleculares que permiten la acción de MYC.
- Cáncer de cabeza y cuello. El Grupo de Supresión Tumoral ha identificado dos marcadores cuya presencia se corresponde con una evolución menos agresiva de estos tumores.
- Cáncer renal. El Grupo de Cáncer Endocrino Hereditario, liderado por Mercedes Robledo, publicó en la revista JCI Insight el hallazgo de varios potenciales biomarcadores de la respuesta al tratamiento con TKIs, fármacos antiangiogénicos muy utilizados.
- Cáncer de mama. Los antiangiogénicos son, como decíamos, ampliamente utilizados en el tratamiento del cáncer pero en algunos pacientes no tienen efecto. Un ensayo clínico promovido por el CNIO ha revelado la eficacia de una prueba para identificar a las pacientes con cáncer de mama que no se beneficiarán de esta terapia.
- Cáncer de pulmón. El Laboratorio de Epigenética CNIO-Lilly, dirigido por María José Barrero, ha descubierto un nuevo subtipo molecular de tumores de pulmón. En concreto, la nueva variante está dentro del grupo de los tumores con mutaciones en el gen RAS y presenta una sobreexpresión de NSD2.
