Esta web utiliza cookies para que podamos ofrecerte la mejor experiencia de usuario posible. La información de las cookies se almacena en tu navegador y realiza funciones tales como reconocerte cuando vuelves a nuestra web o ayudar a nuestro equipo a comprender qué secciones de la web encuentras más interesantes y útiles.
Columna
Estimados/as Amigos/as:
Una de las lecciones que hemos aprendido con la pandemia producida por el virus Sars-Cov-2 es que la Humanidad es vulnerable, y que es la ciencia la que nos da esperanzas para tener soluciones a esta crisis sanitaria y otras crisis globales que puedan ocurrir en el futuro. En menos de un año, científicos y científicas de todo el mundo han actuado de manera coordinada, sistematizada y sin fronteras, para encontrar el virus que causaba la enfermedad y conocer su mecanismo de infección con el objetivo de generar vacunas y encontrar tratamientos efectivos contra esta nueva enfermedad.
Del mismo modo, la única manera de tener esperanza en que cada día se curen más pacientes de cáncer pasa por la investigación. El pasado 24 de septiembre celebramos en el CNIO el Día Mundial de la Investigación del Cáncer con la jornada titulada Una nueva era para la investigación del cáncer: hacia la implicación de toda la sociedad. Además de destacar la importancia de la investigación básica como motor de nuevos avances con el seminario del científico español Francis Mojica, descubridor del sistema CRISPR, también destacamos la necesaria participación de los/as ciudadanos/as en una materia que les afecta directamente a través de iniciativas como “Amigos/as del CNIO”. Os animo a ver íntegra esta jornada tan interesante en este enlace.
Nuestro invitado de excepción en este encuentro, Francis Mojica, es un ejemplo de vocación y entusiasmo genuino. Y su hallazgo básico de hace unas décadas en el ADN de unas bacterias fue el cimiento de la técnica de edición genética CRISPR, que acaba de ganar el Premio Nobel de Química por su potencial para revolucionar la investigación de enfermedades como el cáncer. Es el mejor ejemplo de que la ciencia es una carrera de fondo, que no podemos renunciar a ninguno de sus pasos por anecdótico que pudiera parecer, ya que sus implicaciones pueden ser inmensas, y que cualquier obstáculo, por mínimo que sea, supone retrasos que no nos podemos permitir para seguir mejorando nuestra salud y calidad de vida.
Maria A. Blasco
Directora
Noticias científicas CNIO
 Ilustración y tomografía computarizada del efecto terapéutico antes y después de inactivar CDK4 y RAF1. A la izquierda se observan dos tumores cuando KRAS se encuentra activando CDK4 y RAF1. A la derecha se observa la desaparición de los tumores tras la inactivación de CDK4 y RAF1. /CNIO
Ilustración y tomografía computarizada del efecto terapéutico antes y después de inactivar CDK4 y RAF1. A la izquierda se observan dos tumores cuando KRAS se encuentra activando CDK4 y RAF1. A la derecha se observa la desaparición de los tumores tras la inactivación de CDK4 y RAF1. /CNIO
Un equipo del Grupo de Oncología Experimental que dirige Mariano Barbacid ha logrado en ratones la regresión de tumores de pulmón causados por KRAS.
El oncogén KRAS está involucrado en al menos una quinta parte de todos los cánceres humanos, pero a día de hoy todavía no se han podido desarrollar estrategias terapéuticas eficaces contra este oncogén. Ahora, el CNIO no solo ha conseguido la remisión completa en un 25% de los tumores mediante la inactivación de CDK4 y RAF1 (dos genes que actúan a diferentes niveles en la vía de señalización de este oncogén). Además, esta combinación terapéutica frenó el crecimiento tumoral en el 100% de los casos.
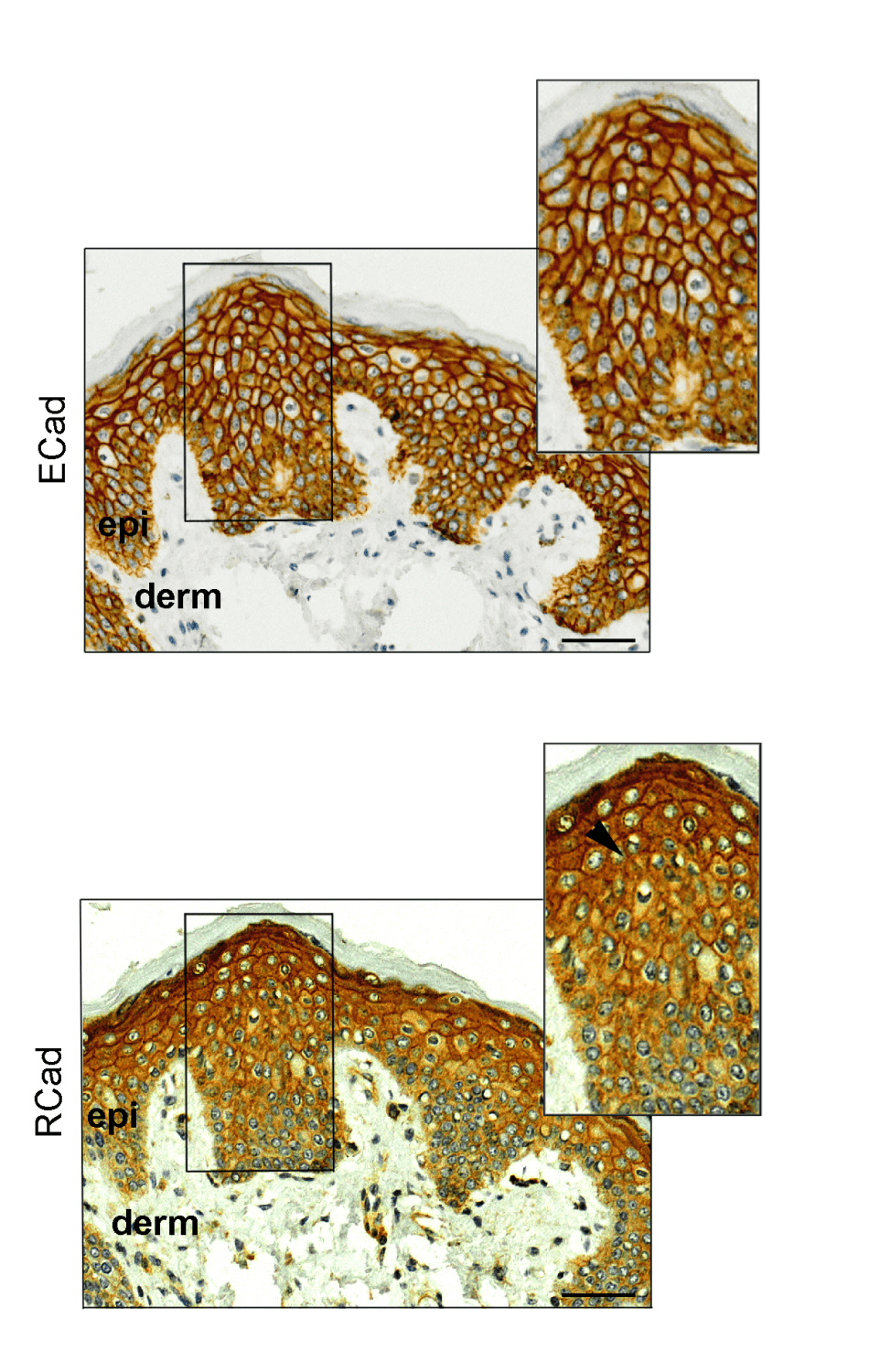 Análisis de inmunohistoquímica de E-caderina (ECad) y R-caderina (RCad) en muestras normales de piel obtenidos de pacientes con cáncer de mama antes del tratamiento con capecitabina. A diferencia de la proteína ECad (arriba), la proteína RCAD (abajo), se expresa mayoritariamente en las capas suprabasales de la epidermis que están implicadas en la aparición del síndrome mano-pie. /CNIO
Análisis de inmunohistoquímica de E-caderina (ECad) y R-caderina (RCad) en muestras normales de piel obtenidos de pacientes con cáncer de mama antes del tratamiento con capecitabina. A diferencia de la proteína ECad (arriba), la proteína RCAD (abajo), se expresa mayoritariamente en las capas suprabasales de la epidermis que están implicadas en la aparición del síndrome mano-pie. /CNIO
Administrar el fármaco capecitabina en la quimioterapia para cáncer de mama y colorrectal aumenta la esperanza de vida de los pacientes de estos tipos de cáncer. Sin embargo, algunos de ellos experimentan una reacción cutánea adversa llamada síndrome mano-pie, que cuando es grave obliga a reducir la dosis o incluso a suspender el tratamiento.
Ahora, un equipo liderado por Anna González-Neira, jefa de la Unidad de Genotipado Humano – CEGEN, ha identificado variantes genéticas que harían que determinados pacientes tengan una predisposición genética a experimentar esta reacción adversa a la capecitabina. Este hallazgo es crucial para poder identificar, antes de iniciar el tratamiento, a las personas que puedan desarrollar esta toxicidad y, por lo tanto, poder personalizar la terapia.
 Imágenes representativas de un tumor no tratado (izquierda) comparado con otro tumor tratado (derecha) con el sistema de edición génica CRISPR para la eliminación de genes de fusión. Las células están teñidas con un marcador de proliferación celular (Ki67). La tinción marrón indica que el tumor no tratado está proliferando con rapidez, mientras que la ausencia de tinción (células en azul) indica que el tumor tratado con CRISPR ha detenido su crecimiento. /CNIO
Imágenes representativas de un tumor no tratado (izquierda) comparado con otro tumor tratado (derecha) con el sistema de edición génica CRISPR para la eliminación de genes de fusión. Las células están teñidas con un marcador de proliferación celular (Ki67). La tinción marrón indica que el tumor no tratado está proliferando con rapidez, mientras que la ausencia de tinción (células en azul) indica que el tumor tratado con CRISPR ha detenido su crecimiento. /CNIO
Investigadores liderados por Sandra Rodríguez-Perales, jefa de la Unidad de Citogenética Molecular, han conseguido por primera vez destruir las células tumorales de sarcoma de Ewing y leucemia mieloide crónica sin afectar a las células sanas, usando las técnicas de edición genética CRISPR para eliminar los genes de fusión causantes de estos tumores.
Los genes de fusión (producto de la unión anómala del ADN de dos genes distintos) son exclusivos de las células tumorales, son excelentes dianas para el desarrollo de futuros fármacos que solo ataquen el tumor y no causen daño a las sanas. El equipo estudiará si la estrategia también es efectiva en otros tipos de cáncer para los que ahora mismo no hay terapias eficaces.
 Marisol Soengas, jefa del Grupo de Melanoma del CNIO (centro), junto a David Olmeda, codirector del estudio, y Daniela Cerezo, primera autora. /A. Garrido, CNIO
Marisol Soengas, jefa del Grupo de Melanoma del CNIO (centro), junto a David Olmeda, codirector del estudio, y Daniela Cerezo, primera autora. /A. Garrido, CNIO
El Grupo de Melanoma que dirige la investigadora Marisol Soengas en el CNIO ha logrado entender cómo el melanoma consigue engañar al sistema inmunitario, no solo para evitar que le ataque, sino incluso para convertirlo en un aliado que coopere con su crecimiento.
Una clave de este engaño está en la proteína MIDKINE, que consigue cambiar las funciones de varios componentes del sistema inmunitario; las buenas noticias son que, al bloquear MIDKINE, el equipo consiguió que las células inmunes volvieran a atacar al tumor. Un hallazgo que ayudará a mejorar la inmunoterapia, una estrategia con gran potencial para tratar el cáncer pero que todavía no es plenamente eficaz.
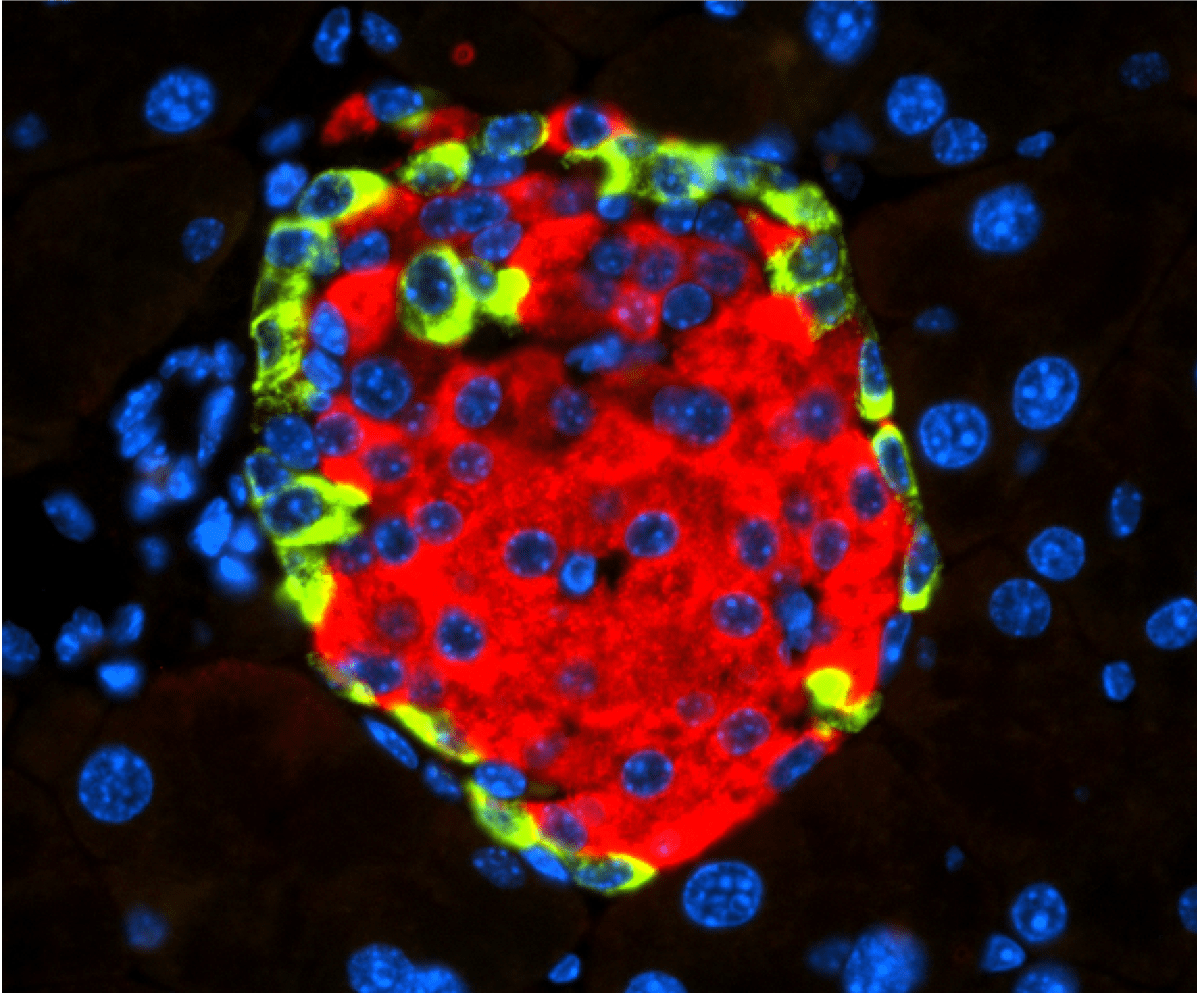 Islotes de Langerhans con insulina secretada por las células beta (en rojo) y glucagón secretado por las células alfa (en verde). /CNIO
Islotes de Langerhans con insulina secretada por las células beta (en rojo) y glucagón secretado por las células alfa (en verde). /CNIO
Investigadores del Grupo de Factores de Crecimiento, Nutrientes y Cáncer que dirige Nabil Djouder ha descrito por primera vez cómo un virus puede causar diabetes, afectando a las funciones y la identidad de las células que generan insulina en el páncreas. Un fenómeno que ya se conocía, pero del que no se comprendía su mecanismo molecular.
El equipo sugiere explorar si el potencial de algunos compuestos ya testados para el tratamiento del cáncer, en combinación con terapias antivirales, podría ser eficaz como estrategia preventiva y terapéutica. Además, el hallazgo podría ser de relevancia para afrontar la pandemia de Covid-19, ya que recientes informaciones clínicas indican que el virus que la causa también podría originar diabetes en algunos pacientes.
Nuestro Centro
 De izqda. a dcha. y de arriba abajo: Francis Mojica, Sandra Rodríguez-Perales, Sonia Vidal, María Luisa Villafranca, Maria A. Blasco, Cristina Villanueva y Luis Paz-Ares. /CNIO
De izqda. a dcha. y de arriba abajo: Francis Mojica, Sandra Rodríguez-Perales, Sonia Vidal, María Luisa Villafranca, Maria A. Blasco, Cristina Villanueva y Luis Paz-Ares. /CNIO
El 24 de septiembre, con motivo del Día Mundial de la Investigación del Cáncer, celebramos el evento Una nueva era en la investigación del cáncer: hacia la implicación de toda la sociedad.
Francis Mojica, profesor titular del Departamento de Fisiología, Genética y Microbiología de la Universidad de Alicante, impartió la ponencia magistral ‘Resolviendo enigmas, combatiendo dolencias, deleitándonos con CRISPR’.
Posteriormente, se celebró una mesa redonda moderada por Cristina Villanueva para debatir los retos del futuro y la implicación de la sociedad para afrontarlos, en la que participaron Maria A. Blasco, directora del CNIO y jefa del Grupo de Telómeros y Telomerasa del Centro; Luis Paz-Ares, jefe de la Unidad de Investigación Clínica de Cáncer de Pulmón H120-CNIO y jefe del Servicio de Oncología Médica del Hospital Universitario 12 de Octubre; Sandra Rodríguez-Perales, jefa de la Unidad de Citogenética Molecular del CNIO, y María Luisa Villafranca, paciente de cáncer de mama y presidenta de la Asociación Rosae, que es miembro de Amigos y Amigas del CNIO.
 Reclutamiento de células inmunosupresoras (rosa) en tumores agresivos de melanoma con altos niveles de Midkine (verde). /CNIO
Reclutamiento de células inmunosupresoras (rosa) en tumores agresivos de melanoma con altos niveles de Midkine (verde). /CNIO
El Grupo de Melanoma que dirige Marisol Soengas en el CNIO ha recibido una financiación en la Convocatoria de Investigación en Salud de la Fundación “la Caixa”, para describir los mecanismos inmunitarios que favorecen la progresión del tumor y proponer estrategias terapéuticas que los bloqueen.
En la convocatoria también se ha seleccionado un proyecto del IRB que cuenta con la participación de Óscar Llorca, jefe del Grupo de Complejos Macromoleculares en la Respuesta a Daños en el ADN del CNIO, para utilizar criomicroscopía electrónica en la comprensión de la fisiología del cerebro.
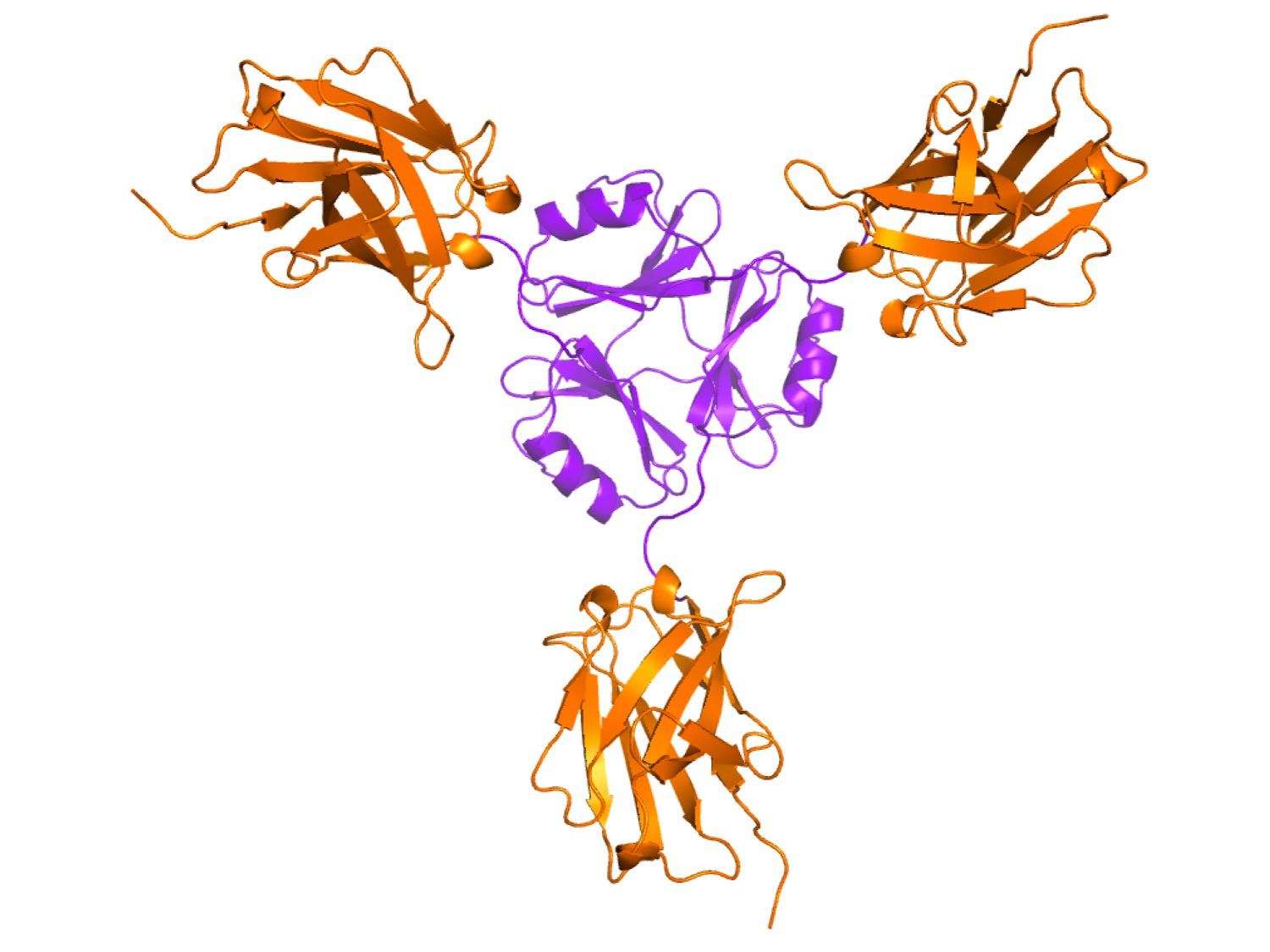 Imagen del primer prototipo de un spikebody. Se utilizará la inmunología sintética como herramienta para diseñar la inmunidad frente a pan-coronavirus. /CNIO
Imagen del primer prototipo de un spikebody. Se utilizará la inmunología sintética como herramienta para diseñar la inmunidad frente a pan-coronavirus. /CNIO
Inés Muñoz, jefa de la Unidad de Cristalografía e Ingeniería de Proteínas del CNIO, colabora con el i+12 en un proyecto para diseñar una nueva técnica de inmunoterapia que genere anticuerpos frente a diferentes tipos de coronavirus, entre ellos el causante de la Covid-19.
El objetivo es crear moléculas con capacidad suficiente para bloquear la infección causada por cualquier coronavirus, y que, como en el caso de la Covid-19, sirvan como tratamiento o prevención en pacientes ingresados con patología severa.
Entrevista
Marisol Soengas: «En poco más de 10 años, se ha conseguido que entre el 50 y el 60% de los pacientes de melanoma responda a la inmunoterapia, al menos de forma transitoria»
 Marisol Soengas. /A. Garrido. CNIO
Marisol Soengas. /A. Garrido. CNIO
Hablamos con Marisol Soengas, jefa del Grupo de Melanoma del CNIO, sobre su último hallazgo en melanoma y sistema inmunitario.
¿Cómo puede ayudarnos el sistema inmunitario a combatir una enfermedad genética como el cáncer?
El sistema inmunitario es la policía interna del organismo encargada de reconocer elementos extraños como virus, bacterias y las células tumorales. Distintos componentes de este batallón de defensa actúan en varias fases. La primera es reconocer moléculas en la superficie de las células malignas que las distinguen de las células normales (de esto se encargan entre otros, los macrófagos). Este proceso es poco eficiente, porque hay pocas patrullas de reconocimiento, así que el segundo paso es reclutar más células inmunitarias en el entorno tumoral. El tercero consiste en activar mecanismos de ataque o degradación y el cuarto paso, es la eliminación de esas células malignas.
Todo este proceso defensivo es realmente muy eficiente, pero en tumores agresivos como el melanoma se producen fallos tanto de reconocimiento como de ataque tumoral. De todos modos, en los últimos años se ha conseguido desarrollar estrategias (anticuerpos) capaces de desactivar mecanismos de protección en distintos tipos tumorales. El melanoma es un ejemplo de estos éxitos de la investigación: en poco más de 10 años, se ha conseguido que entre el 50-60% de los pacientes responda a la inmunoterapia, al menos de forma transitoria. En este momento hay más de 3.000 ensayos clínicos en muchos otros tipos tumorales, con buenos resultados por ejemplo en cáncer de pulmón, entre otros. De todos modos, en muchos pacientes los efectos secundarios son importantes y el porcentaje de pacientes resistentes a terapia es importante.
Habéis descubierto que el melanoma ‘engaña’ a nuestro sistema inmunitario. ¿Cómo lo consigue?
Sí, esta publicación describe cómo el melanoma no solo se oculta del sistema inmunitario, sino que, además, es capaz de reorientar su función, de tal manera que, en lugar de encontrarse en conformación de reconocimiento y ataque, se convierta en un infiltrado que apoye el desarrollo tumoral. Identificamos una proteína denominada Midkine que media este cambio de función. Además, demostramos que bloqueando Midkine se aumentaba la respuesta a inmunoterapia en modelos animales y describimos genes asociados a esta reversión en muestras de pacientes. Finalmente, describimos efectos inmunomoduladores de Midkine en glioblastomas, carcinomas de pulmón o renales. Midkine está alterada también en otras patologías, así que creemos que nuestros resultados abrirán nuevas vías de investigación en la oncología.
¿Cuáles serán los próximos pasos de la investigación?
Tenemos estudios muy interesantes sobre efectos de Midkine sobre distintos componentes del sistema inmunitario que nos permitirá entender mejor cómo melanomas en fases muy iniciales de la enfermedad, adquieren ya una gran capacidad maligna y metastásica. Estamos además desarrollando ensayos para poder generar inhibidores farmacológicos de Midkine, que intentaremos estudiar en distintos modelos experimentales.
Perfil
José Luis Rodríguez Zapatero

José Luis Rodríguez Zapatero, presidente del Gobierno de España entre 2004 y 2011, impartió una charla el 15 de septiembre dentro del ciclo de encuentros WISE de la Oficina de la Mujer en Ciencia del CNIO. Bajo el título Ciencia y política, Rodríguez Zapatero pidió la creación de una comisión de alto nivel formada por científicos, economistas, pensadores y tecnólogos, cuyo criterio sea incuestionable, para proponer los proyectos que vayan a ser financiados con los fondos europeos para la reconstrucción debido a los efectos de la pandemia de la Covid-19.
A la visión de la ciencia como vía para mejorar la salud y la esperanza de vida, el expresidente quiso añadir su papel como elemento de convivencia fundado en principios y valores. Así, resaltó la igualdad entre hombres y mujeres como uno de esos principios fundamentales, incidiendo en que el siglo XXI debe ser el definitivo en favor en la igualdad de género.
José Luis Rodríguez Zapatero (1960) es licenciado en Derecho por la Universidad de León. Fue elegido diputado nacional por León (1986-2004) y Madrid (2004-2011). Entre 2000 y 2012, ocupó el cargo de Secretario General del Partido Socialista Obrero Español (PSOE). Es Doctorado Honoris Causa de la Universidad Toulouse 1 Capitole, Francia (2015), de la Universidad Mayor de San Andrés, Bolivia (2015), y de la Universidad Autónoma de Santo Domingo, República Dominicana (2017). Preside el Foro de la Contratación Socialmente Responsable y forma parte del Real Patronato sobre Discapacidad, del Patronato de CERMI Mujeres, del Club de Madrid y de la Comisión Internacional Contra la Pena de Muerte. Es autor del libro El dilema. 600 días de vértigo, publicado por la editorial Planeta en 2013.
Entre sus principales acciones al frente del Gobierno, destacan iniciativas legislativas como la Ley Integral contra la Violencia de Género (2004), la que reconoce el matrimonio entre personas del mismo sexo (2005), la Ley de Igualdad efectiva entre mujeres y hombres, la conocida como Ley de Memoria Histórica (2007) o la Ley de Víctimas del Terrorismo (2011).
